|
【発展】混成軌道と結合 メタンCH4は,C原子と,H原子4つが共有結合している。C-Hの共有結合はC原子の電子軌道とH原子の電子軌道(【発展】電子軌道(原子軌道)参照)が重なり合うことで,互いの電子を共有すると考える。 メタンの4つH原子は等価なので,C原子の最外殻の4つの電子も等価でなければならない。しかし,C原子を電子軌道で考えると,最外殻(2s,2p)に入る4つの電子は等価でなない。そこで,2s軌道と3つの2p軌道が混ざって4個の等価な軌道(この場合,sp3混成軌道という)ができると考える。この4個の軌道は等価なので正四面体の立体空間に広がっていく。このようにして考えられた軌道を混成軌道という。 |
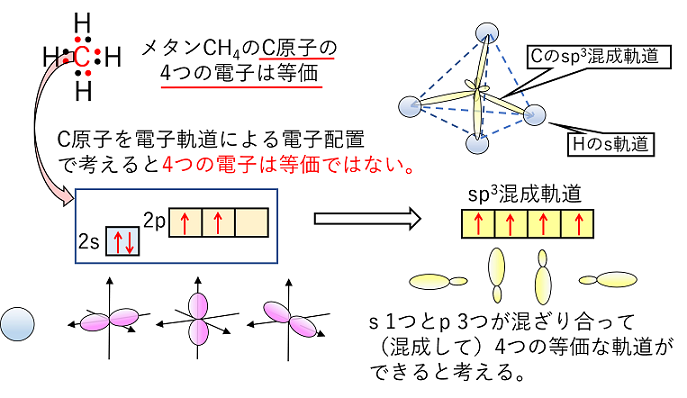 |
| エチレンCH2=CH2ではC原子がs軌道とp軌道2つが混成して等価な3つの軌道(sp2混成軌道)ができる。この3つの軌道は平面上に広がっていく。sp2混成軌道となった場合は,p軌道が1つ余るので,C原子どうしの二重結合では,1本はsp2どうしの重なりによる結合,もう1本はp軌道どうしの重なりによる結合となる。 |
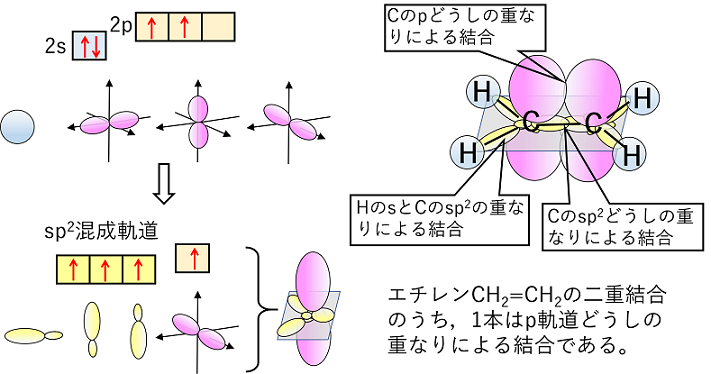 |
|
アセチレンHC≡CHでは,C原子がs軌道とp軌道1つが混成して等価な2つの軌道(sp混成軌道)となる。この2つの軌道は直線上に広がっていく。sp混成軌道となった場合は,p軌道が2つ余るので,C原子どうしの三重結合では,1本はspどうしの重なりよる結合,もう2本はp軌道どうしの重なりによる結合となる。 |
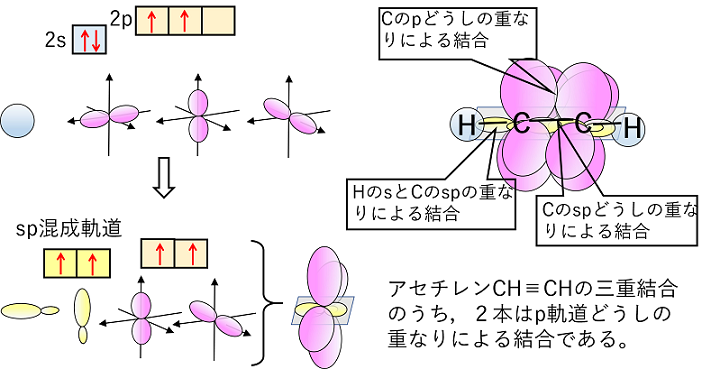 |
|
σ結合とπ結合 単結合にみられる直線的に軌道が重なり合うことによってできる結合をσ結合という。また,二重結合や三重結合にみられるp軌道が側面で重なり合うことによってできる結合をπ結合という。σ結合は強い共有結合を形成し,π結合は比較的弱い共有結合となる。二重結合のうち1本,三重結合の2本は切れやすいのはそのためである。 |
 |